Nombre de reproduction de base

Pour les articles homonymes, voir R0.
En épidémiologie, le nombre de reproduction de base ou (ratio 0) d'une infection peut être défini comme le nombre moyen attendu de cas directement générés par un cas dans une population où tous les individus sont sensibles à l'infection[1],[2].
C'est un paramètre permettant de modéliser l'évolution d'une épidémie au fil du temps, en supposant que le facteur pathogène ne mute pas et que l'immunité acquise dure au-delà de la période épidémique.

Définition et propriété de base
varie en fonction de trois facteurs principaux : la durée de la phase contagieuse, la probabilité d'une transmission de l'infection lors d'un contact, et le nombre moyen de contacts d'une personne contaminée. À cela peuvent s'ajouter, selon les modèles utilisés pour le déterminer, des facteurs socio-économiques et environnementaux, qui peuvent conduire à des estimations différentes de ce [3].
Croissance ou décroissance exponentielle
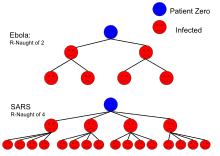
« Le [est] le nombre moyen de personnes qu’une personne contagieuse peut infecter[4]. »
Supposons qu'un « patient zéro » se trouve d'une manière ou d'une autre en position de contaminer son environnement, le mécanisme de propagation de l'infection sera par hypothèse le suivant en moyenne :
- Au premier rang de transmission, individus seront infectés ;
- Ceux-ci étant à leur tour contaminants, chacun contaminera personnes, et donc au deuxième rang de transmission, individus seront infectés ;
- Ceux-ci étant à leur tour contaminants, chacun contaminera personnes, et donc au troisième rang de transmission, individus seront infectés ;
- ... ; et donc au nème rang de transmission, individus seront infectés ; et ainsi de suite[5].
Le nombre de personnes infectées varie donc exponentiellement.
Une propriété importante de ce est que :
- Si , la croissance sera exponentielle, et l'épidémie va se propager. En général, plus la valeur de est grande, plus il est difficile de maîtriser l'épidémie ;
- Si , la décroissance sera exponentielle et l'épidémie va s'éteindre.
Nombre de reproduction effectif

En réalité, le ne décrit l'évolution d'une maladie qu'à ses tout débuts.
« Ce taux s’applique, et se calcule à partir d’une population qui est entièrement susceptible d’être infectée, c’est-à-dire qui n’a pas encore été vaccinée ni immunisée contre un agent infectieux[4]. »
Lorsqu'une fraction de la population a déjà été infectée ou est immunisée, les contacts avec cette fraction ne conduiront pas à des contaminations supplémentaires, et seule la fraction reste susceptible d'être contaminée. Dans ce cas, le nombre de reproduction effectif sera :
D'autre part, lorsque l'épidémie s'étend exponentiellement, la fraction diminue également exponentiellement, réduisant d'autant le effectif. Dans ce cas, pour des petites valeurs de , on montre que la courbe de contamination est bien approchée par une courbe logistique. Au fur et à mesure qu'une fraction de plus en plus importante de la population est touchée, le effectif diminue et finit par devenir inférieur à l'unité : la vitesse de propagation diminue ; et à partir d'un certain point, c'est la décroissance qui devient exponentielle, et l'épidémie s'éteint d'elle-même[6],[7],[8].
Seuil d'immunité collective
Le permet également de déterminer la proportion minimale au sein d'une population () qui doit être immunisée par l’infection naturelle ou par vaccination (si disponible) pour empêcher le déclenchement ou la persistance d’une épidémie :
- , ou encore :
On parle à ce propos d'effet d'immunité collective (immunité grégaire, herd immunity) pour désigner le pourcentage de la population qui devrait être immunisée pour que l’épidémie cesse de prospérer.
L'évolution d'une épidémie par rapport à ce point dépend du nombre de cas actifs. Quand ce point est atteint, la courbe de nouveaux cas passe par un maximum et commence à décroître. Ce n'est pas encore la fin de l'épidémie, mais le plus dur est passé.
Si cette proportion est présente dès le début d'une épidémie, par exemple à la suite d'une immunisation acquise lors d'une épidémie précédente, ou par une campagne de vaccination, alors l'épidémie sera étouffée dans l’œuf et ne pourra pas se développer.
Inversement, dans une situation d'endémie, pour laquelle le nombre de personnes affectées est relativement stable et le effectif proche de l'unité, la proportion de personnes n'ayant pas eu la maladie est égale à .
Ratio 0 et politique sanitaire

Le fond de cet article concernant les sciences médicales ou vétérinaire est à vérifier ().
Améliorez-le ou discutez des points à vérifier. Si vous venez d’apposer le bandeau, merci d’indiquer ici les points à vérifier.
Mesures sanitaires
La modélisation de base est que, en moyenne, un individu infectieux établit contacts infectieux par unité de temps, pendant une période infectieuse moyenne de . Le nombre de reproduction de base sera alors :
Cette durée est une donnée biologique de la maladie.
- en traquant et trouvant les individus infectieux dès que possible ;
- puis en les isolant, et les traitant ; ou en les éliminant (dans le cas des animaux).
Afin d'estimer l'effet de cette politique sur le , des hypothèses sont nécessaires sur le délai entre l'infection et le diagnostic, le délai entre l'infection et le début de la contamination, et la durée de la période contaminante. Si un diagnostic peut être posé avant même le début de la phase de contamination, et conduit à un isolement strict, il est clair que le sera réduit à pratiquement zéro, et l'épidémie sera stoppée net. Si le diagnostic est plus tardif, un isolement reste d'autant plus efficace qu'il est rapide et permet de réduire par l'isolement la durée de la période contaminante.
Le facteur , en revanche[Information douteuse], est une donnée sociologique. Cette formule simple suggère différentes manières de réduire , et finalement la propagation de l'infection. Il est possible de diminuer le nombre de contacts infectieux par unité de temps :
- en réduisant le nombre de contacts par unité de temps (par exemple rester à la maison si l'infection nécessite un contact avec les autres pour se propager) ;
- ou en réduisant la proportion de contacts qui produisent une infection (par exemple avec le port d'équipement de protection).
En isolant les deux facteurs précédents, le taux peut finalement être écrit de manière équivalente, sous la forme [9]
où est le taux de contact entre individus sensibles et infectés, et est la transmissibilité, c'est-à-dire la probabilité d'infection lors d'un contact.
Cette formulation est parlante, et permet de comprendre les différentes stratégies utilisées pour maîtriser une épidémie, mais est sans utilité pratique pour ce qui est des modélisations quantitatives de sa modélisation.
Effets d'une politique sanitaire
Une stratégie de prévention consiste à donner à la population concernée un a priori, tel que l'immunité collective est atteinte dès avant le début de l'épidémie, interdisant par là même un développement significatif.
- Sur le plan médical, le développement d'une stratégie adaptée de détection et de soins d'une maladie permettra d'augmenter l'efficacité générale du système de santé, réduisant a priori la durée ou la contagiosité de cette maladie[Information douteuse], et donc sa capacité à se transformer en épidémie ;
- Sur le plan de la politique de santé, une campagne de vaccination préventive peut amener la proportion de population immunisée au-dessus du seuil d'immunité collective ;
- Sur le plan social, la capacité d'une société à transmettre un agent pathogène peut être diminuée par l'éducation générale à des gestes réflexes d'hygiène (ne pas cracher par terre, se protéger la bouche quand on tousse…), réduisant dans l'absolu la proportion de contacts qui produisent une infection.
Face à une épidémie en phase montante, le fait même que l'épidémie se répande montre que le correspondant est significativement supérieur à l'unité. Les stratégies possibles consistent alors à accentuer les mesures sanitaires et sociales précédentes par des mesures exceptionnelles, ce qui permet de réduire le :
- Rechercher activement les personnes contagieuses, et les isoler en quarantaine obligatoire ;
- Appeler à une vigilance accrue en matière d'hygiène.
Observation directe
Le nombre de reproduction de base peut être estimé en examinant les chaînes de transmission détaillées, ou par séquençage génomique. Cependant, il est le plus souvent calculé à l'aide de modèles épidémiologiques[10].
Mesure du ratio 0

On distingue bien les différents pics épidémiques (juillet 2020, octobre 2020, février 2021, juillet 2021) avec leurs pentes symétriques de croissance et de décroissance.
Ces pics peuvent être dus à la contamination de nouveaux « bassins épidémiques » (région jusque là épargnée), et/ou à l'apparition de variants contre lesquels l'immunité précédemment acquise n'opère plus.
Sur une courbe épidémiologique décrivant le nombre de nouveaux cas et tracée dans un repère semi-logarithmique, dans ce cas idéal, on verra dans un premier temps la courbe monter suivant une droite croissante (phase de croissance exponentielle), puis s'infléchir, et descendre suivant la pente inverse (phase de décroissance exponentielle). Comme discuté ci-dessous, il est possible d'estimer le à partir de la pente de la courbe.
- On peut théoriquement suivre, sur de telles courbes, l'effet de politiques de santé ayant pour effet de faire varier le à la suite de leur mise en application : l'effet sera en principe de diminuer la pente de la courbe, mais également de ralentir symétriquement la décroissance, et donc globalement d'étaler l'épidémie dans le temps.
- À partir de modélisations, il est théoriquement possible de calculer la hauteur du pic à partir du , si l'on connaît la taille de la population concernée.
Il faut cependant être conscient que ce mécanisme, qui parle d'une « fraction de la population », ne peut suivre ce modèle que si la population a un périmètre défini, et est à la fois homogène, et isolée du reste du monde. Une immunité collective, acquise à l'échelle d'une région, peut néanmoins coïncider avec la contamination d'une région voisine non encore atteinte, déclenchant un nouveau pic de contamination à l'échelle nationale ; et dans ce cas, le signal du « pic » et sa symétrie théorique apparaîtront beaucoup plus brouillés par l'enchevêtrement des progressions géographiques.
Exemples de calcul
Le dépend de divers facteurs : région, comportements, densité de population, organisation sociale ou saisonnalité. Il ne s'agit donc pas d'une constante. Il est sujet à de nombreuses erreurs d'interprétation, et son calcul de se révèle difficile[11].
| Maladie | Mode de transmission | R0 |
|---|---|---|
| Rougeole | aérien | 12–18 |
| Coqueluche | aérien | 12–17 |
| Varicelle | aérien | 10–12 |
| COVID-19 - Variant Omicron | aérien | ~10 [13]–12 à 15[14] |
| COVID-19 - Variant Delta | aérien | 7,5 (J-F Delfraissy) [15] |
| Diphtérie | contact (salive) | 6–7 |
| Variole | contact | 5–7 |
| Polio | contact (matière fécale) | 5–7 |
| Rubéole | aérien | 5–7 |
| Oreillons | aérien | 4–7 |
| VIH/SIDA | contact (sang, sperme, sécrétions vaginales) | 2–5[16] |
| Syndrome respiratoire aigu sévère | aérien | 2–5[17] |
| Grippe (grippe espagnole de 1918) | aérien | 2–3[18] |
| COVID-19 (souche d'origine) | aérien et contact | 2-4 |
Caractère fluctuant du ratio 0
Le est un concept utile pour ce qui est du raisonnement qualitatif, mais il serait illusoire d'en attendre une mesure précise et stable dans une situation donnée.
En effet, la « transmissibilité » varie suivant les conditions des rencontres, et est extrêmement difficile à évaluer quantitativement même en conditions standardisées. Elle varie également suivant les conditions saisonnières : un agent pathogène qui prospère dans les conditions froides et humides, comme la grippe « saisonnière », voit son efficacité s'effondrer en été, diminuant d'autant le .
De son côté, le « taux de contact » est extrêmement variable suivant le caractère sociable ou non du porteur (solitaire ou serveur de bar ?) ou du groupe social dans lequel il s'insère (club échangiste ou société d'Amish face à une MST). Il doit de plus prendre en compte la connectivité d'un groupe social à l'autre : une épidémie aviaire se transmettra très rapidement dans une même volière, mais les contacts d'une volière à une autre sont beaucoup plus limités. Enfin, il variera dans des proportions drastiques en cas d'épidémie importante, du seul fait de la variation des comportements : quand pendant les grandes épidémies de choléra les villageois accueillaient les étrangers à coup de fourche, la capacité d'un porteur à contaminer cette population s'en trouvait très diminuée.
Les discussions sur ce paramètre doivent donc être comprises comme des analyses essentiellement qualitatives, et les valeurs citées comprises comme des ordres de grandeurs plutôt que des seuils scientifiquement déterminés.
Ratio 0 et modélisation épidémiologique
Vitesse de croissance de l'épidémie

Pendant une épidémie, généralement le nombre d'infections diagnostiquées au fil du temps est connu. Aux premiers stades d'une épidémie, la croissance est exponentielle en , avec un taux de croissance logarithmique tel que :
Dans un repère semi-logarithmique, la courbe correspondante est une droite (aux fluctuations et erreurs de comptage près). Inversement, dans un tel tracé, à chaque fois que la courbe du nombre de nouveaux cas tend à être une droite, cela implique que le sous-jacent est resté constant, et donc qu'il n'y a pas eu de modification sensible à cette échelle du comportement général ou de la politique de santé.
Pour une croissance exponentielle, en début d'épidémie (où tout part d'une valeur négligeable), peut être interprété indifféremment comme le nombre cumulé de diagnostics (y compris les individus qui se sont rétablis) ou le nombre actuel de cas d'infection ; le taux de croissance logarithmique est le même pour l'une ou l'autre définition. En pratique, en début d'épidémie, la lecture est plus sûre sur le nombre cumulé de cas, qui porte sur des quantités plus importantes et a de ce fait des fluctuations moins importantes. En revanche, pour apprécier des pentes instantanées en cours d'épidémie, la mesure n'est généralement possible que sur le nombre de nouveaux cas.
Lien avec l'évolution temporelle
Les segments en droite ligne constatés dans un repère semi-logarithmique permettent de donner une première estimation du .
Après la contamination initiale du sujet de base, les personnes contaminées le sont « en moyenne » après un temps , qui dépend du temps d'incubation et de la durée de la période de contamination, et éventuellement du caractère plus ou moins contagieux en début ou en fin de cette période. Si l'on fait par exemple l'hypothèse simplificatrice que la contagiosité est uniforme sur la période, le délai moyen de contamination au rang 1 sera celui séparant la contamination initiale du milieu de la période contaminante.
D'un rang à l'autre les délais de contamination seront de plus en plus étalés, mais la loi des grands nombres fait que le délai moyen de contamination au rang sera alors , c'est-à-dire fois le délai moyen au premier rang. Inversement, au bout d'un temps , le rang atteint sera en moyenne le rang .
En reportant cette valeur dans la loi de croissance du nombre de cas, le nombre de nouvelles contaminations au bout d'un temps sera :
On a donc :
- , ou inversement :
C'est cette dernière formule qui permet de mesurer le effectif, à partir de la pente du nombre de cas nouveaux, et du délai moyen de contamination .
Temps de doublement
En croissance exponentielle, est lié au temps de doublement comme
Le , nombre sans dimension, ne dit rien, par lui-même, sur le temps de doublement d'une maladie, qui a la dimension d'un temps. Clairement, si une personne en contamine deux en moyenne, le temps de doublement sera beaucoup plus bref si la durée d'incubation et la période de contamination sont courtes, et sera du même ordre de grandeur que celles-ci.
Afin d'estimer , des hypothèses sont nécessaires sur le délai entre l'infection et le début de la contamination, et la durée de la période contaminante. Si l'on suppose pour simplifier qu'un malade est uniformément contagieux d'un bout à l'autre de sa période contaminante, le délai moyen de contamination pour le premier « rang » qu'il contamine est le milieu de cet intervalle de temps, soit : , et dans ce cas, le délai moyen de contamination sera :
On en déduit le temps de doublement par la formule d'évolution précédente :
- , soit encore :
Vitesse de récession de l'épidémie

Lorsque la vague épidémique s'apaise, le seuil d'immunité collectif a été franchi, et le effectif est devenu inférieur à l'unité. En queue d'épidémie, ce nombre de reproduction (qui dépend de la proportion de la population touchée et devenue immunisée) est sensiblement constant, et « toutes choses égales par ailleurs », on peut calculer le lien théorique entre ce nombre et le initial :
- ;
La décroissance est alors exponentielle. Tracée dans un repère semi-logarithmique, la pente correspondante de la courbe est alors :
Pour de petites valeurs de , et toutes choses égales par ailleurs :
- La somme des pentes ascendante et descendante est du second ordre, donc ces deux pentes sont sensiblement symétriques l'une de l'autre ;
- Cette somme tend à être négative, donc l'épidémie décroît plutôt plus vite qu'elle n'a crû.
Si est faible, on peut poser , avec du second ordre.
Dans ce cas, le effectif ayant peu varié, il y a eu sensiblement autant de cas avant qu'après le franchissement du seuil, mais le effectif ayant constamment diminué, la proportion finale est au second ordre un peu inférieure au double de P : , avec du second ordre.
En remplaçant les pentes initiales et finales et des courbes par leurs valeurs, on trouve, après développement limité, que leur somme est également du second ordre :
C'est ce qui permet de dire que pour les faibles épidémies, la courbe des cas cumulés est sensiblement une sigmoïde. Pour les épidémies sévères, la population tend à modifier ses comportements entre-temps, changeant de ce fait la valeur du , et il n'y a plus de raison que cette symétrie puisse être observée.
En dehors de tels pics symétrique, l'interprétation est inversement que ces conditions de son apparition n'ont en tout cas pas été remplies : la population exposée ne l'a pas été de manière homogène dans l'espace ou dans le temps, ou les mesures sanitaires ou sociales ont été modifiées, induisant un changement dans la progression de la courbe.
Notes et références
- ↑ (en) James Holland Jones. Notes on R0. Stanford University, 1/05/2007
- ↑ « Qu’est-ce que le « R0 », le taux de reproduction du virus ? », Le Monde.fr, (lire en ligne, consulté le )
- ↑ Viceconte G & Petrosillo N (2020) COVID-19 R0: Magic number or conundrum?. Infectious Disease Reports, 12(1).
- ↑ a et b (en) Giulio Viceconte et Nicola Petrosillo, « COVID-19 R0: Magic number or conundrum? », Infectious Disease Reports, vol. 12, no 1, (ISSN 2036-7449 et 2036-7430, PMID 32201554, PMCID PMC7073717, DOI 10.4081/idr.2020.8516, lire en ligne, consulté le )
- ↑ En toute rigueur, le nombre d'individus infectés est en moyenne , et la loi de répartition au rang est le produit des lois élémentaires. La variable aléatoire est donc modélisée par une loi log-normale, dont l'espérance « en moyenne » est bien .
- ↑ Garnett GP, « Role of herd immunity in determining the effect of vaccines against sexually transmitted disease », The Journal of Infectious Diseases, vol. 191 Suppl 1, no Suppl 1, , S97-106 (PMID 15627236, DOI 10.1086/425271
 )
) - ↑ Rodpothong P, Auewarakul P, « Viral evolution and transmission effectiveness », World Journal of Virology, vol. 1, no 5, , p. 131–4 (PMID 24175217, PMCID 3782273, DOI 10.5501/wjv.v1.i5.131)
- ↑ Dabbaghian V, Mago VK, Theories and Simulations of Complex Social Systems, Springer, , 134–35 p. (ISBN 978-3642391491, lire en ligne)
- ↑ J.H. Jones, Notes sur R0. Université de Stanford (2007).
- ↑ Wohl S, Schaffner SF, Sabeti PC, « Analyse génomique des épidémies virales », Revue annuelle de virologie, vol. 3, , p. 173–195 (PMID 27501264, PMCID 5210220, DOI 10.1146/annurev-virologie-110615-035747, lire en ligne)
- ↑ Paul L. Delamater, Erica J. Street, Timothy F. Leslie et Y. Tony Yang, « Complexity of the Basic Reproduction Number (R0) », Emerging Infectious Diseases, vol. 25, no 1, , p. 1–4 (ISSN 1080-6040, PMID 30560777, PMCID 6302597, DOI 10.3201/eid2501.171901, lire en ligne, consulté le )
- ↑ Sauf lorsque des références sont données, les valeurs de proviennent de (en) History and Epidemiology of Global Smallpox Eradication du cours "Smallpox: Disease, Prevention, and Intervention" par le Centers for Disease Control and Prevention (CDC) et l'Organisation mondiale de la santé (OMS), diapositives 16-17. Consulté le 3 mars 2010.
- ↑ « Covid-19 : l'arrivée d'Omicron peut-elle relancer le débat sur l'immunité collective ? », TV5 Monde, (lire en ligne)
- ↑ Pascal Crépey, « Omicron : les problèmes que pose un variant trois fois moins sévère, mais deux fois plus transmissible », Sud Ouest, (lire en ligne)
- ↑ « Covid-19 : une quatrième vague, "différente" des précédentes, pourrait arriver à la rentrée », Midi libre, (lire en ligne)
- ↑ (en) Anderson RM, May RM, « Population biology of infectious diseases: Part I », Nature, vol. 280, no 5721, , p. 361–7 (PMID 460412, DOI 10.1038/280361a0)
- ↑ (en) Wallinga J, Teunis P, « Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures », Am. J. Epidemiol., vol. 160, no 6, , p. 509–16 (PMID 15353409, DOI 10.1093/aje/kwh255, lire en ligne)
- ↑ (en) Mills CE, Robins JM, Lipsitch M, « Transmissibility of 1918 pandemic influenza », Nature, vol. 432, no 7019, , p. 904–6 (PMID 15602562, DOI 10.1038/nature03063, lire en ligne)
Bibliographie
- Bacaër N., « Mathématiques et épidémies », Cassini, 2021.
- « Covid-19 : une quatrième vague, "différente" des précédentes, pourrait arriver à la rentrée », Midi libre, (lire en ligne)
- « Covid-19 : l'arrivée d'Omicron peut-elle relancer le débat sur l'immunité collective ? », TV5 Monde, (lire en ligne)
Voir aussi
- Modèles compartimentaux en épidémiologie (définition)
- Superinfecteur (définition)
- Diamond Princess (navire de croisière) (exemple)
 Portail de la médecine
Portail de la médecine  Portail des probabilités et de la statistique
Portail des probabilités et de la statistique















































![{\displaystyle K_{1}={\frac {\ln[(1-p).R_{0}]}{\theta }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5ddf7289ec84b5718e6fba6411c71f4befc48ba)





![{\displaystyle K+K_{1}={\frac {\ln[R_{0}]}{\theta }}+{\frac {\ln[(1-2(1-1/R_{0})+\epsilon ).R_{0}]}{\theta }}=2{\frac {\ln[1+\rho ]}{\theta }}+{\frac {\ln[{\frac {2}{1+\rho }}-1-2\epsilon ]}{\theta }}\approx -2{\frac {\epsilon }{\theta }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83905267f8d4b463262af715c00d1689057478fd)













